
乳酸菌作為食源性微生物具有被*的食用安全性,其在發酵過程中產生的胞外多糖(exopolysaccharide,EPS)被廣泛應用于食品生產、制藥、生物工程、生物絮凝劑以及化工生產領域 。常見的產胞外多糖乳酸菌主要有植物乳桿菌、嗜熱鏈球菌、雙歧桿菌等 。近年來,越來越多不同來源的產胞外多糖乳酸菌被分離出來,并得到了深入的研究。與植物多糖相比,乳酸菌胞外多糖具有*的理化特性,如低質量濃度時的高黏度、濃稠特性,剪切稀釋特性等,這主要是由于乳酸菌胞外多糖的單糖組成、單糖之間糖苷鍵連接位點、糖鏈分支結構等的不同造成的。
乳酸菌胞外多糖的結構特性除了與菌株自身的遺傳因素相關外,環境因素如培養基的碳源、氮源、菌株的生長溫度等也有較大的影響。此外,乳酸菌胞外多糖也存在一些共同的特征,如乳酸菌胞外多糖一般由葡萄糖、半乳糖、鼠李糖、甘露糖、氨基糖等組成;大多數乳酸菌胞外多糖具有較好的親水性;許多細菌胞外多糖由于可以在水相和油相之間形成穩定的乳化液,因此可以作為生物乳化劑應用于工業生產中 。
關于乳酸菌胞外多糖的研究大多數采用基于全脂乳的培養基或合成、半合成培養基,如乳酸細菌培養基、史娃茲鑒別培養基等,然而這些培養基在發酵過程中易形成絡合物,對胞外多糖的生成和量化有一定的影響 。本研究采用基于脫脂乳的培養基,對本課題組從西藏靈菇中分離到的兩株植物乳桿菌(菌株YW11和菌株SKT109)在生長過程中產生的胞外多糖進行分離純化,研究純化胞外多糖的理化性質,為其進一步工業化應用開發提供技術支持。
植物乳桿菌YW11(NCBI:KM265361)、植物乳桿菌SKT109(NCBI:KJ764641),均保存于北京工商大學實驗室。
三氯已酸(trichloroacetic,TCA)、濃硫酸、重蒸酚、無水乙醇、十六烷、間羥聯苯、四硼酸鈉(均為分析純) 國藥集團化學試劑有限公司;脫脂乳粉新西蘭恒天然乳品有限公司;離子交換柱填料 DEAESepharose Fast Flow 英國Waterman公司;Sepharose CL-6B層析柱填料 瑞典Amersham Bioscience公司;透析袋(8 000~14 000 D) 北京鼎國生物技術有限公司。
脫脂乳培養基:葡萄糖20.0 g、脫脂乳粉12.5 g,去離子水1 L,攪拌均勻后置于95 ℃滅菌15 min。
CR21GⅢ立式高速冷凍離心機、U3900紫外分光光度計 日本Hitachi公司;MLS-3750高壓蒸汽滅菌器日本三洋公司;BX53電子顯微鏡 日本奧林巴斯公司;ALV/CGS-3一體式光散射儀 德國ALV公司;Nexus470紅外光譜儀 美國Nicolet公司;5975C型氣相色譜儀美國安捷倫公司;XHF-DY高速勻漿機 寧波新芝生物科技股份有限公司。
將植物乳桿菌連續活化兩代后轉接至脫脂乳培養基中,37 ℃靜置培養16 h,然后加入80%TCA至其在發酵液中最終質量濃度為4 g/L。常溫下攪拌2 h,4 ℃、10 000 r/min離心45 min去除發酵液 中的細胞和蛋白。取上清液,加入兩倍體積的無水乙醇,4 ℃冷藏12 h,再于4 ℃、10 000 r/min離心30 min。采用去離子水復溶沉淀物,并移入透析袋,每8 h換一次去離子水,透析24 h后冷凍干燥得到粗多糖。
配制20 mg/mL的粗多糖溶液,經DEAE-Sepharose Fast Flow離子交換柱層析(2.6 cm×40 cm)純化,進樣5 mL,線性梯度洗脫,1~30 管用去離子水、31~60 管用0.2 mol/L NaCl溶液、61~100 管用0.5 mol/L NaCl溶液,控制洗脫速率為1 mL/min,自動集樣,每管收集5 min,檢測多糖含量,合并收集單一峰組分,透析,冷凍干燥。
經離子交換層析得到的多糖組分用質量濃度9 g/L的NaCl溶液溶解后,上樣至Sepharose CL-6B凝膠柱層析(2.5 cm×50 cm),進樣量5 mg,進樣量2 mg/mL。采用9 g/L的NaCl溶液洗脫,洗脫速率為0.5 mL/min,每管收集5 mL,檢測每管多糖含量,按多糖含量檢測值分別合并收集單一峰組分,去離子水透析,冷凍干燥,獲得EPS純品。
總糖含量:采用苯酚-硫酸法;多糖中蛋白質含量:采用考馬斯亮藍比色法;糖醛酸含量:采用間羥聯苯法;水分含量:采用稱質量法。
準確稱取2 mg EPS,KBr壓片,使用Nexus 470紅外光譜儀測定。
配制0.1 mol/L NaNO 3溶液,將EPS溶解到NaNO 3溶液中,質量濃度為0.5 g/L。輕輕攪動至*溶解。過0.22 μm濾膜,置于無塵處理過的石英散射池(25 mm)中,使用ALV/CGS-3一體式光散射儀測定EPS流體力學半徑R h。散射角為90°,功率22 mW,波長:632.8 nm。
多糖的酸水解與單糖衍生化參考王輯研究方法,單糖標準品為鼠李糖、葡萄糖、半乳糖、阿拉伯糖、木糖、果糖、巖藻糖。色譜條件:色譜柱類型,DB-5毛細管柱(60 m×0.25 mm,0.25 μm);進樣量1 μL;氧火焰離子檢測器;載氣流速:1 mL/min;分流比:1∶30;升溫程序:80 ℃保持3 min,5 ℃/min升至195 ℃保持1 min,5 ℃/min升至215 ℃保持1 min,10 ℃/min升至230 ℃保持3 min。
取不同質量濃度(0.5~2.5 g/L)的胞外多糖水溶液2 mL,加入 3 mL橄欖油,使用高速勻漿機3 600 r/min均質2 min,轉移到刻度試管中,分別于24、168、360 h測定并按式(1)計算乳化指數(E),表示為E 24、E 168、E 360。

式中:h e為乳化層高度/cm;h t為總高度/cm。
分別將質量濃度為1.0 g/L的胞外多糖和質量濃度為0.5 g/L的刺槐膠、黃原膠、海藻酸鈉或瓜爾豆膠按質量比1∶1混合,取混合液2 mL加入3 mL橄欖油,均質,測定168 h時的乳化指數(E 168)。
質量濃度1.0 g/L的EPS水溶液和質量濃度0.5 g/L的其他乳化劑(刺槐膠、海藻酸鈉、黃原膠、瓜爾豆膠)溶液按質量比1∶1混合,分別取混合液2 mL,加入0.5 mL十六烷,旋渦振蕩1 min,分別在旋渦振蕩前、后迅速測定混合液540 nm波長處吸光度(A 0)。振蕩后的混合液在室溫條件下靜置30 min后,測定540 nm波長處吸光度的降低值(A t)。按公式(2)計算乳化穩定性。
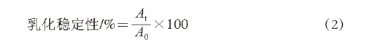
制備質量濃度1.0 g/L的胞外多糖乳化液,室溫靜置24 h后取60 μL乳化液,置于顯微鏡(100×)下觀察并拍照,乳化顆粒的大小及分布情況,通過Image Pro Plus軟件分析,乳化顆粒度半徑及分布通過SPSS 21.0軟件繪制直方圖進行分析。
實驗樣品3 次平行,以±s表示,SPSS 21.0軟件進行方差分析,P<0.05表示差異顯著。
植物乳桿菌菌株YW11和菌株SKT109分別于脫脂乳培養基中培養,經TCA除蛋白、離心、乙醇沉淀、透析、冷凍干燥后得到胞外多糖粗品。此兩種粗多糖用于進一 步純化。
菌株YW11和菌株SKT109粗多糖經離子交換柱的洗脫曲線如圖1所示。YW11胞外多糖的洗脫峰出現在以0.5 mol/L的NaCl溶液作為洗脫液時(圖1A),表明此胞外多糖帶有電荷,為酸性多糖。SKT109胞外多糖的洗脫峰出現在以水作為洗脫液時(圖1B),表明此組分不帶電荷,為中性多糖。分別收集洗脫峰,經透析、冷凍干燥后得到蓬松狀、白色的SKT109胞外多糖和YW11胞外多糖樣品。
圖1 DEAE-Sepharose Fast Flow離子交換柱層析純化植物乳桿菌菌株YW11(A)和菌株SKT109(B)EPS洗脫曲線 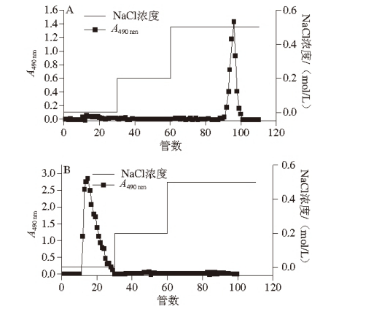
圖2 Sepharose CL-6B凝膠柱層析純化植物乳桿菌胞外多糖EPSEPS YW11YW11(A)和EPSEPS SKT109KT109(B)的洗脫曲線 
由于離子交換柱分離得到的多糖樣品可能含有帶相同電荷的不同組分,因此,需進一步采用凝膠層析按各組分分子質量的不同分離純化。兩種多糖樣品經Sepharose CL-6B凝膠柱層析(圖2),分別得到多糖的單一峰(圖2A、B),經透析和冷凍干燥獲得該兩種多糖的純品,分別記為EPS YW11和EPS SKT109,用于以下的實驗。對此兩種多糖純品的進一步分析表明,經過純化后的EPS SKT109和EPS YW11中的總糖含量分別為92.31%、89.02%,純度較高;蛋白質含量分別為1.25%、1.01%;糖醛酸含量分別為0%、5.44%。兩種多糖的水分含量均在4%左右。
單糖標準品的保留時間從左到右依次為鼠李糖(26.203 min)、巖藻糖(26.406 min)、阿拉伯糖(26.499 min)、木糖(26.904 min)、果糖(31.503 min)、葡萄糖(31.726 min)、半乳糖(31.891 min)。EPS YW11在保留時間為31.787 min和31.901 min時出峰,表明EPS YW11主要由葡萄糖和半乳糖兩種單糖構成,EPS SKT109在保留時間為31.726 min和31.896 min時出峰,表明該EPS也由葡萄糖和半乳糖構成。通過面積歸一化法定量分析可得,EPS YW11中葡萄糖與半乳糖物質的量比為3.45∶1,EPS SKT109中葡萄糖與半乳糖物質的量比為1.43∶1。Zhang Li等報道植物乳桿菌C88胞外多糖的單糖組成為葡萄糖和半乳糖(物質的量比為2∶1)。不同植物乳桿菌胞外多糖的單糖組成存在差異可能與產糖菌株、培養基類型和發酵條件有關。
在3 294.2 cm -1(EPS YW11)和3 361.7 cm -1(EPS SKT109)處存在寬展圓滑的強吸收峰是由羥基伸縮振動造成的,表明多糖分子中存在大量的羥基。在2 968.3 cm -1(EPS YW11)和2 875.4 cm -1(EPS SKT109)處存在一個弱峰,歸屬于多糖分子中—CH 2的C—H伸縮振動,是多糖的特征吸收峰。在1 647.7 cm -1(EPS YW11)處存在一個強吸收峰,可能與胞外多糖中環狀結構的C=O伸縮振動有關,在1 675.3 cm -1(EPS SKT109)處存在一個中強吸收峰,可能與C=C伸縮振動有關,Wang Jing等研究發現,此處出現紅外吸收峰可能是由于半乳糖或甘露糖的存在造成的,進一步驗證了兩種多糖的單糖組成中存在半乳糖。在1 539.4 cm -1(EPS YW11)和1 581.3 cm -1(EPS SKT109)處存在弱的吸收峰,可能與N—H的彎曲振動有關,此峰可能是多糖中存的少量蛋白質造成的。在反應胞外多糖等高聚物的精細結構的指紋區(1 500~500 cm -1),吸收峰1 231.4 cm -1(EPS YW11)和1 291.4 cm -1(EPS SKT109)的出現可能與酯基存在有關,表明多糖結構中可能會出現CH 3COOR,Ai Lianzhong等對干酪乳桿菌LC2W胞外多糖的研究也有類似報道。
動態光散射技術具有對樣品無干擾、測量信息量大、易操作、分析速度快等優點,采用該項技術直接測定得到的高聚物分子流體力學半徑(R h)能夠反映大分子在溶液中的尺寸,是研究高聚物流變特性的重要參數。通過ALV/CGS-3一體式光散射儀測定得到EPS YW11和EPS SKT109在NaNO 3溶液中的R h值分別為69.20 nm和41.74 nm。這與Shao Li等研究鼠李糖乳桿菌KF5胞外多糖的R h(59.4 nm)相接近。Schmitt等研究發現,溶液中大分子顆粒尺寸的差異可能會導致其不同的界面特性,一定范圍內顆粒粒徑越大,能夠更有效地保持流體界面的穩定性。
表1 不同質量濃度EPS YW11和EPS SKT109的乳化指數 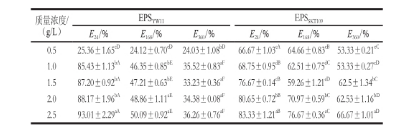
注:同行肩標小寫字母不同表示差異顯著(P<0.05);同列肩標大寫字母不同表示差異顯著(P<0.05)。
EPS SKT109E 24/%E 168/%E 360/%E 24/%E 168/%E 360/% 0.525.36±1.65 cD24.12±0.70 cD24.03±1.08 bD66.67±1.03 eA64.66±0.83 cB53.33±0.21 cC1.085.43±1.13 bA46.35±0.85 bE35.52±0.83 aF68.75±0.95 dB62.51±0.75 dC53.33±0.27 cD1.587.20±0.92 bA47.21±0.63 bE33.23±0.36 aF76.67±0.14 cB59.26±1.21 eD62.5±1.34 bC2.088.17±1.96 bA48.86±1.11 aE34.38±0.08 aF80.65±0.72 bB70.97±0.59 bC62.53±1.16 bD2.593.01±2.29 aA50.09±0.92 aE36.26±0.76 aF83.33±1.21 aB76.67±0.36 aC66.67±1.01 aD質量濃度/(g/L)EPS YW11
EPS YW11和EPS SKT109在不同質量濃度(1.0~2.5 g/L)下的乳化指數及其隨時間延長的乳化穩定性如表1所示。在相同質量濃度下,EPS YW11的乳化指數( E 24)均明顯高于EPS SKT109,表明EPS YW11的乳化能力強于EPS SKT109,這可能是由于在乳化初期,酸性多糖EPS YW11除了親水基團的作用外,其他帶電粒子與橄欖油中帶相反電荷的基團相互作用,形成雙分子層,加強了油滴之間的靜電相互作用,從而增強了多糖的乳化能力。另一方面,EPS YW11的R h大于EPS SKT109的R h,可能增強了其界面穩定性,因而導致乳化能力提高。
隨著多糖的質量濃度從0.5 g/L增加到2.5 g/L,此兩種胞外多糖的乳化指數具有不同程度的增加,酸性胞外多糖EPS YW11的乳化指數(E 24)增加幅度最大,從25.94%增加到93.08%;而中性胞外多糖EPS SKT109的乳化指數增加幅度較小,從66.67%增加到83.33%。Han Yuzhu等研究發現,解淀粉芽孢桿菌LPL061胞外多糖在質量濃度為1.0 g/L時表現出較好的乳化特性,表明胞外多糖只有在到達一定的質量濃度時,才能起到較好的乳化作用。本研究中,植物乳桿菌EPS YW11和EPS SKT109在質量濃度為2.5 g/L時呈現較好的乳化特性。這可能是由于多糖質量濃度的增加,可導致整個體系黏度的增加,同時多糖分子中親水官能團(—CH 2等)的存在對多糖的乳化性起到一定的促進作用。
不同乳化能力的乳化劑混合,可以導致形成的乳化液的界面膜強度增加,而高強度的界面膜是形成穩定乳化液的原因之一。本實驗以乳化指數(E 168)作為指標,研究了EPS YW11和EPS SKT109與其他4 種親水乳化劑的協同效應;以乳化穩定性為指標,研究了此乳化協同效應的穩定性,結果如表2所示。EPS YW11與黃原膠復配時,乳化指數(E 168)達到89.58%,乳化能力較好,而與其他乳化劑復配時的乳化能力較單獨使用EPS YW11(46.35%)的差異相對較小。EPS SKT109與刺槐膠或瓜爾豆膠復配時,乳化指數(E 168)分別為79.41%和76.47%,乳化能力較單獨使用EPS SKT109(62.51%)有所提高,而當EPS SKT109與海藻酸鈉和黃原膠復配時,乳化指數顯著降低,一方面可能是由于多糖與凝膠復配后,協同體系的質量濃度較大,多余的乳化劑因絮凝作用導致顆粒聚集下沉,另一方面是由于協同效應影響乳化顆粒粒徑,從而導致乳化體系失衡。EPS YW11與黃原膠復配時其乳化穩定性為61%,而與其他乳化劑混合乳化時,乳化穩定性都偏高,這表明在EPS YW11與黃原膠復配時,表現了較好的乳化穩定性。EPS SKT109在 與刺槐膠和瓜爾豆膠復配時,乳化穩定性為83%和75%,也表現出了相對較好的乳化穩定性。注:同列肩標小寫字母不同表示差異顯著(P<0.05)。
表2 EPS YW11和EPS SKT109與不同乳化劑的協同效應 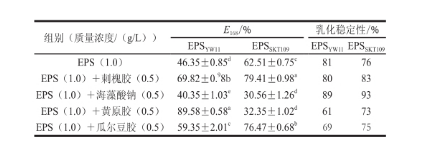
組別(質量濃度/(g/L))E 168/%乳化穩定性/% EPS YW11EPS SKT109EPS YW11EPS SKT109EPS(1.0) 46.35±0.85 d62.51±0.75 c8176 EPS(1.0)+刺槐膠(0.5)69.82±0. 98b79.41±0.98 a8083 EPS(1.0)+海藻酸鈉(0.5)40.35±1.03 e30.56±1.26 d8993 EPS(1.0)+黃原膠(0.5)89.58±0.58 a32.35±1.02 d6173 EPS(1.0)+瓜爾豆膠(0.5)59.35±2.01 c76.47±0.68 b6975
本研究對植物然桿菌YW11和SKT109在基于脫脂乳培養基中發酵產生的胞外多糖進行了分離純化,分別獲得了酸性多糖EPS YW11和中性多糖EPS SKT109純品。此兩種胞外多糖的紅外光譜均存在多糖的特征吸收峰;其單糖組成均為葡萄糖和半乳糖,但兩種單糖的物質的量比不同。對EPS YW11和EPS SKT109乳化特性的研究表明,二者均可形成相對較小的乳化顆粒,呈現良好的乳化特性;EPS SKT109乳化顆粒半徑略低于EPS YW11,前者具有相對更好的乳化穩定性。
同時,兩種胞外多糖與常用的乳化劑具有不同程度的乳化協同效應,其中EPS YW11與黃原膠復配時的協同效應明顯,且具有較好的乳化穩定性。本研究獲得的植物乳桿菌胞外多糖EPS YW11和EPS SKT109在食品工業中具有潛在的應用開發前景。
相關鏈接:植物乳桿菌,脫脂乳培養基,多糖,糖醛酸,干酪乳桿菌,北納生物
聲明:本文章來源于網絡,如有版權問題,請與本網聯系
技術支持:化工儀器網 管理登陸 sitemap.xml